Tento článek byl původně znovu publikován z The Conversation.
Uvedení nového léku na trh stojí miliardy dolarů a může trvat déle než deset let. Tyto vysoké finanční a časové investice silně přispívají k dnešním raketově rostoucím nákladům na zdravotní péči a zároveň jsou významnými překážkami v poskytování nových terapií pacientům. Jedním z velkých důvodů za těmito překážkami je laboratorní model, který výzkumníci používají k vývoji léků.
Preklinické studie nebo studie, které testují účinnost a toxicitu léku před tím, než vstoupí do klinických studií na lidech, se provádějí hlavně na buněčných kulturách a zvířatech. Oba jsou limitováni svou špatnou schopností napodobovat podmínky lidského těla. Buněčné kultury v Petriho misce nejsou schopny replikovat každý aspekt tkáňové funkce, například jak buňky interagují v těle nebo dynamiku živých orgánů. A zvířata nejsou lidé – i malé genetické rozdíly mezi druhy mohou být zesíleny na velké fyziologické rozdíly.
Méně než 8 % úspěšných studií léčby rakoviny na zvířatech se dostává do klinických studií na lidech. Vzhledem k tomu, že zvířecí modely často nedokážou předpovědět účinky léků v klinických studiích na lidech, mohou tato selhání v pozdní fázi významně zvýšit jak náklady, tak zdravotní rizika pacientů.
K vyřešení tohoto problému s překladem výzkumníci vyvinuli slibný model, který může blíže napodobovat lidské tělo – orgán na čipu.
Jako analytický chemik jsem pracoval na vývoji modelů orgánů a tkání, které se vyhýbají jednoduchosti běžných buněčných kultur a nesrovnalostem zvířecích modelů. Věřím, že s dalším vývojem mohou orgány na čipech pomoci výzkumníkům studovat nemoci a testovat léky v podmínkách, které jsou bližší skutečnému životu.
Co jsou orgány na čipech?
Koncem 90. let vědci přišli na způsob vrstvení elastických polymerů pro kontrolu a zkoumání tekutin na mikroskopické úrovni. To odstartovalo oblast mikrofluidiky, která pro biomedicínské vědy zahrnuje použití zařízení, která dokážou napodobit dynamické proudění tekutin v těle, jako je krev.
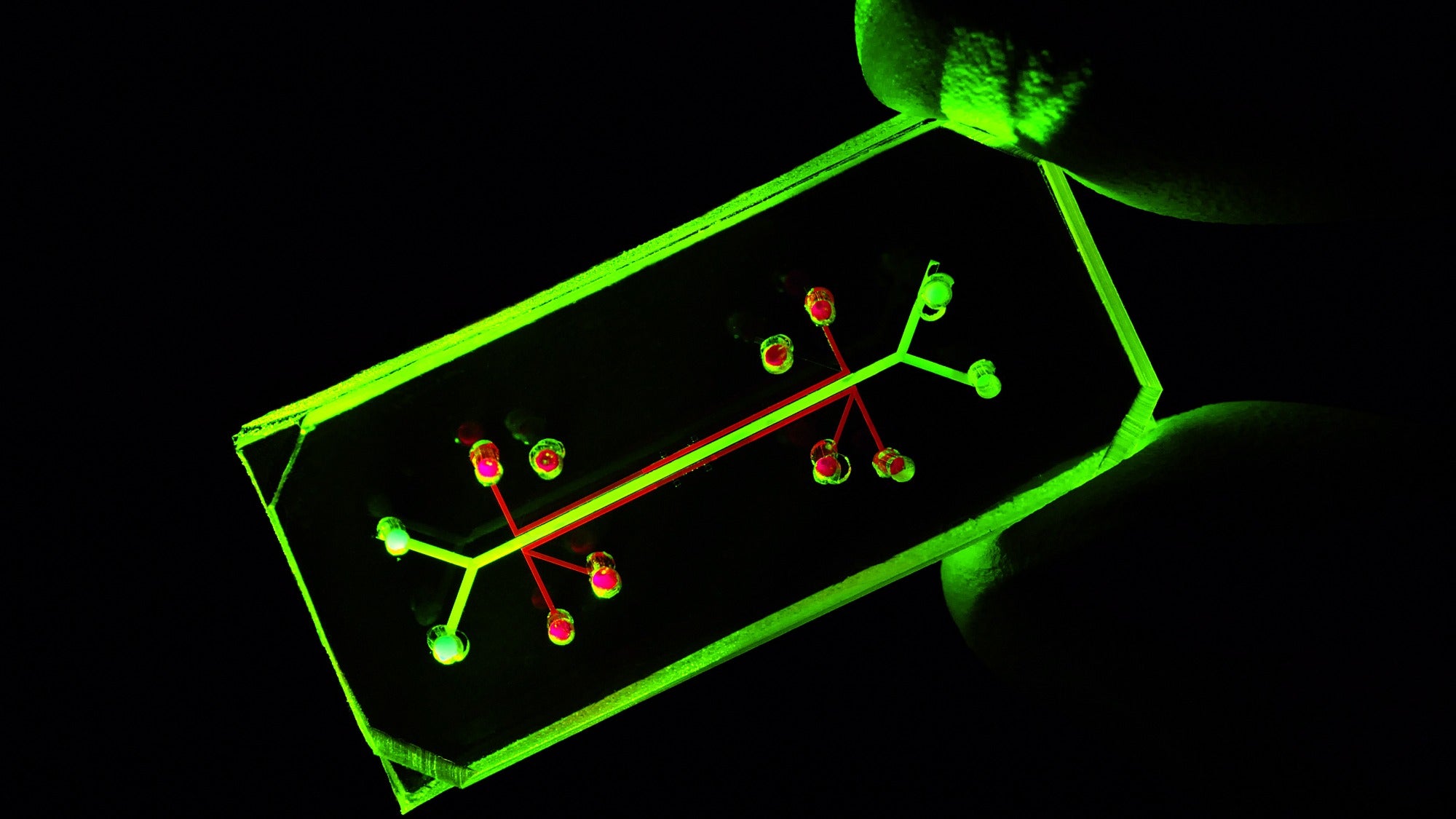
Pokroky v mikrofluidice poskytly výzkumníkům platformu pro kultivaci buněk, které fungují blíže tomu, jak by fungovaly v lidském těle, konkrétně s orgány na čipech. „Čip“ označuje mikrofluidní zařízení, které obaluje buňky. Jsou běžně vyráběny stejnou technologií jako počítačové čipy.
Nejen, že orgány na čipech napodobují průtok krve v těle, tyto platformy mají mikrokomory, které výzkumníkům umožňují integrovat více typů buněk, aby napodobily rozmanitou škálu typů buněk, které se normálně v orgánu vyskytují. Proudění tekutiny spojuje tyto různé typy buněk, což umožňuje výzkumníkům studovat, jak na sebe vzájemně působí.
Tato technologie může několika způsoby překonat omezení statických buněčných kultur i studií na zvířatech. Za prvé, přítomnost tekutiny proudící v modelu umožňuje napodobit to, co buňka v těle prožívá, například jak přijímá živiny a odstraňuje odpady, a jak se lék bude pohybovat v krvi a interagovat s různými typy buněk. Schopnost řídit průtok tekutin také umožňuje výzkumníkům doladit optimální dávkování pro konkrétní lék.
Například model plíce na čipu je schopen integrovat mechanické i fyzické vlastnosti živých lidských plic. Je schopen napodobit dilataci a kontrakci nebo nádech a výdech plic a simulovat rozhraní mezi plícemi a vzduchem. Schopnost replikovat tyto vlastnosti umožňuje výzkumníkům lépe studovat poškození plic napříč různými faktory.
Přivedení orgánů na čipy do měřítka
Zatímco organ-on-a-chip posouvá hranice raného stádia farmaceutického výzkumu, tato technologie nebyla široce integrována do potrubí vývoje léků. Věřím, že hlavní překážkou pro široké přijetí takových čipů je jejich vysoká složitost a nízká praktičnost.
Současné modely orgánů na čipu jsou pro běžného vědce těžko použitelné. Vzhledem k tomu, že většina modelů je jednorázových a umožňuje pouze jeden vstup, což omezuje to, co mohou výzkumníci v daném čase studovat, je jejich implementace nákladná a časově i pracně náročná. Vysoké investice potřebné k používání těchto modelů mohou utlumit nadšení z jejich přijetí. Koneckonců, výzkumníci často používají nejméně složité modely dostupné pro preklinické studie, aby snížili čas a náklady.

Snížení technické laťky při výrobě a používání orgánů na čipech je zásadní pro to, aby celá výzkumná komunita mohla plně využít jejich výhod. To ale nutně nevyžaduje zjednodušení modelů. Moje laboratoř například navrhla různé „plug-and-play“ tkáňové čipy, které jsou standardizované a modulární, což umožňuje výzkumníkům snadno sestavovat předem vyrobené díly pro provádění svých experimentů.
Nástup 3D tisku také významně usnadnil vývoj organ-on-a-chip, což umožňuje výzkumníkům přímo vyrábět celé modely tkání a orgánů na čipech. 3D tisk je ideální pro rychlé prototypování a sdílení návrhů mezi uživateli a také usnadňuje hromadnou výrobu standardizovaných materiálů.
Věřím, že orgány na čipech mají potenciál umožnit průlom v objevování léků a umožnit výzkumníkům lépe porozumět tomu, jak orgány fungují ve zdraví a nemoci. Zvýšení dostupnosti této technologie by mohlo pomoci vyřadit model z vývoje v laboratoři a umožnit mu, aby se prosadil v biomedicínském průmyslu.
Chengpeng Chen, odborný asistent chemie a biochemie, University of Maryland, Baltimore County. Chengpeng Chen dostává finanční prostředky od NIH.
Zdroj: revistamijardin.es, google.cz, pixabay, sciencefocus, nedd.cz